产生颜色的 5 种方式
发布时间:2022-02-23
颜色无比神奇,人们可以用它来形容世间万物,也可以用它来抒发人最深沉的感悟,它给人类带来了无穷的乐趣。我们生活在一个色彩斑斓的世界,如晶莹的水晶、清澈的流水、闪亮的金属、绚丽的花朵、乌黑的煤、雪白的盐等,大自然演奏出和谐的色彩交响曲。人类语言中关于色彩的比喻不胜枚举,无不处处体现着人类与色彩的千丝万缕的联系。色彩促使人类接近大自然,色彩丰富人类的生活。然而,物质的颜色问题是一个很复杂的问题,影响因素很多,一些物质的呈色常常有多种起因,因此要想准确地预测某种化合物的颜色往往还是很困难的事情。
1、分子振动产生的颜色
能够产生颜色的视觉系统的物理输入方式有很多,相对而言,单独由振动吸收导致颜色的现象是不常见的。我们知道,振动和转动对每一个电子能级提供了附加能级,使得吸收和发射光谱发生一定的变更。比如观看大体积的冰和水时,有淡蓝色或蓝色的颜色出现,尤其是观看湖泊、大海及部分深水游泳池等场所,这种颜色就来自于 H2O 分子中纯正的 H-O 振动。此外,紫色的碘蒸气、绿色的氯气及一些火焰的蓝色发射等,都属于这种振动能级跃迁产生颜色的类型。
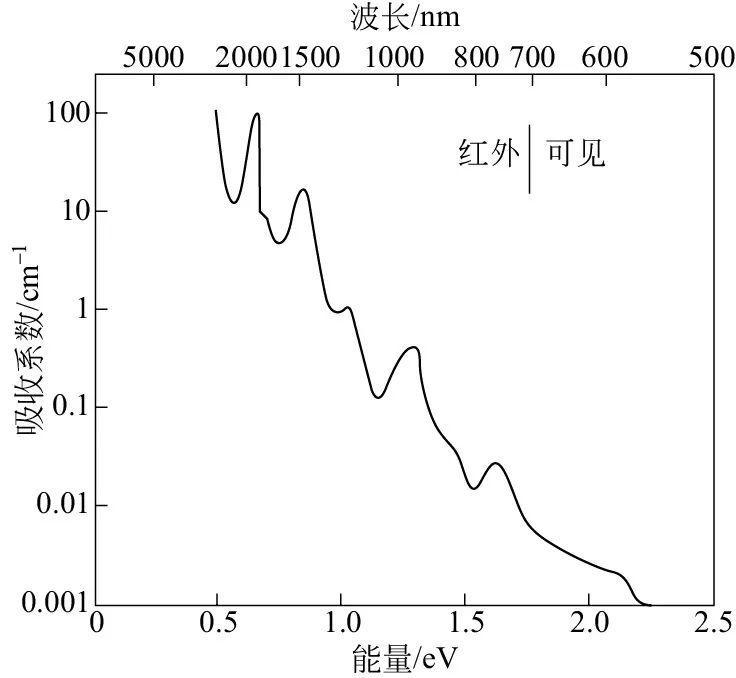
水的吸收光谱是很复杂的,如图所示,在红外区包括一系列窄的强吸收带,在接近可见光区域,吸收峰的强度快速减弱,从红外到可见光区过渡的光谱红端还有少量的吸收,正是该红色吸收给出了它的补色——淡淡的蓝色。
2、简单激发产生的颜色
某种颜色的呈现总要涉及能级间的电子跃迁,但下面讲述的原子、分子固有能级间的电子直接跃迁与后面章节中讨论的多种形式化学键的变化产生的能级跃迁有很多不同之处。
原子是由原子核和若干不断运动的核外电子形成的体系,原子的能级是量子化的,在正常的情况下,原子处于稳定状态,它的能量是最低的,这种状态称为基态。但当原子受到外界能量(如热能、电能等)的作用时,原子由于与高速运动的气态粒子或电子相互碰撞而获得了能量,使原子核外层的电子从基态跃迁到更高的能级上,处于这种状态的原子称为激发态。处于较高能量的轨道上的电子十分不稳定,在极短的时间内会立即发生由高能级向低能级跃迁,释放多余的能量,以一定波长光的形式发射出来。原子中电子能级之间的跃迁产生光的概念,是气体激发产生颜色的核心。
比如所有气体放电灯的工作原理都是基于放电管内的电子、原子、离子之间的相互碰撞。较为剧烈的气体放电现象有很多,如中学物理中关于尖端放电的实验、科技馆中进行的电磁屏蔽与放电演示等,由于高的电场作用导致间隙很小区域内气体的电离,产生火花(电弧)。电在通过空气时能将空气加热,产生光辐射;热也使空气膨胀,完成放电之后,已膨胀的空气收缩并发出爆裂声,这是夏季易出现雷鸣电闪现象的根本原因。气体放电光源主要有低压汞蒸气放电灯、高压汞蒸气放电灯、高压钠蒸气放电灯、金属卤化物放电灯、无极放电灯和准分子光源等。1910 年,法国人 Claude 把用直流电激发的 Geissler 管发展成氖管。氖管中心区域很窄,以限制其放电并加强亮度。氖或者氖加氩产生红光;氩或氩和汞一起产生蓝光;氦产生粉红光,氪产生浅紫色,氙产生蓝色。如利用有色玻璃泡,氖的红光和氩的蓝光可以分别转变为黄光或绿光。氦、氪、氙等价格昂贵,发光强度也不够大,一般不选用这类气体。稀有气体广泛用于广告招牌,闪动着迷人色彩的霓虹灯是稀有气体放电的具体应用。如果霓虹灯灯管内充上氦-氖-氩的混合气体及微量的汞,通电后则发出亮绿色的灯光。调整或改变稀有气体的混合比例,可发出亮蓝色的光等。
又比如钠蒸气灯在制造时加入少量氖气,氖触发气体放电,其热量使钠气化,因此在通电几分钟内,钠灯的颜色从氖的粉红色变为钠的黄色。提高钠的温度与压力,使用氧化铝管,可以得到近于白色的光,这种钠蒸气灯曾用于街道的夜晚照明。由于低压钠灯产生的辐射是单色的黄光,因此只能用于分辨率要求不高的场合,如窄街小巷的照明常用低功率的低压钠灯;主要干道和公路则多数用高功率的低压钠灯;停车场照明、泛光照明、保安照明等,也可选用低压钠灯。
还有稀土三基色荧光灯,发光体的一种重要应用是荧光灯。荧光灯的光线之所以较普通灯强,是因为在荧兴灯管内壁涂有一层发光材料,灯管内充有汞蒸气和氩气的混合物。当有电流通过此灯管时,汞原子上的价电子将受到激发跃迁到较高电子能态,当它们跳回基态时,同时发射出两种特征波长为 254.0 nm和 185.0 nm的紫外线。这种光辐射到灯管内壁的发光材料上,随即发出较强的白光。
3、与能带及色心相关的颜色
金属单质颜色的来源涉及电子在能带间的跃迁,如金属铜的红色、银的白色、金的黄色、铋的淡红色、铅的淡蓝色等,都起因于金属原子的电子在价带和导带间的跃迁。离子晶体显色与离子间的极化作用相关,色心是离子晶体显色的另一个重要起因。由于离子晶体中的一些本征缺陷或杂质缺陷使得其电子轨道延伸到周围基质离子中去,因而可以把这些缺陷及其周围离子的缔合体看作是这类晶体的光吸收或发射的光学活性中心,从而显示出一定的颜色。如无色的 NaCl 和 CaF2 晶体,因 F 色心而使得 NaCl 晶体显黄色、CaF2 晶体显红紫色等。色心的类型有多种,如 F 色心、F' 色心、F2 色心、Vk 色心、F2+ 色心等,各种色心在一定条件下是可以相互转化的。
金属的光泽来自于对光的强吸收和高反射,而金属的态密度图决定了在光谱的不同区域有不同的吸收状态,从而产生了不同的颜色。
4、无机物颜色成因
电子对可见光的选择吸收是分子化学中化合物呈色的重要起源,不同物质具有不同的分子结构及电子能级,因而发生电子跃迁的类型也就有很大的差异。分子轨道间电子跃迁引起的颜色是物质呈色原因中最为重要的一大类型。
化合物呈色的本质:无机物之所以能呈现出各种各样绚丽多彩的颜色,最根本的原因是分子结构中的外层价电子能够对可见光发生选择性吸收,且化合物能够反射和透射某些波长的光。形成化合物时的反应条件(如加料顺序与方式、反应温度、反应物类别、溶剂种类等)、所形成化合物的颗粒大小、表观状态、聚集状态等因素,直接影响到化合物与光作用时发生的一些光学现象,如散射、干涉、衍射等。化合物的化学组成、晶型、配位数、各种异构现象、介质和溶剂极性等因素,同样可影响化合物的最终颜色。
NaCl 、Na2S 、NaBr 、KCl 等离子晶体都应是无色透明的,但我们平时见到的实物却都是白色的,这实际上只是一种光学现象。谈到白色,我们总会想到大雪之后,遍地银装素裹的洁白世界。但如果取出一小片雪花观察,就会发现它是形状非常规则的六面结晶体,是无色透明的。但是为什么一片片雪花堆叠在一起以后,就会变成白色了呢?我们用玻璃来说明这个道理。大块的玻璃是无色透明的,当光线照射以后,会在上面发生折射和反射。因为折射光和反射光遵守着一定的规律,经过反射和折射的光的成分和原来一样,我们可以透过它们看到后面的物体。比如,当你隔着玻璃橱窗看里面的陈列品时,你的视力不自觉地会集中在陈列品上,所以往往察觉不到玻璃的存在。这时,你的自然感觉就是玻璃是透明、无色的。当你把玻璃捣成碎渣,每块碎渣当然还是无色透明的。但是它们的形状、大小没有规则,碎块之间又夹杂着大量的空气,所以当光线照射到上面后,经历了一系列的折射、反射的曲折、复杂过程,不仅使反射光线的方向失去了规则,也使得透射光线的大部分被吸收掉,于是,这堆玻璃渣失去了透明性,也就不再是无色的了。当你观察这堆玻璃渣时,眼睛聚焦在其表面上,从表面反射出来的光虽然没有规则的方向,但它们具有原来入射光中的一切成分。所以,你感觉到它们的颜色就是白色。雪花、白糖、粉末状的食盐等物质呈现白色的道理与此相同。小粒的食盐和白糖,在放大镜下看都是无色透明的,但大量堆积在一起时就变为白色不透明的。所以我们应该将这些物质的白色与滑石粉、白面、可赛银(涂料中一种常用的白色粉末状物质)等物质的白色相区别。虽然它们作用于我们眼里的都是白光的一切成分,但前者是光学性质体现的结果,而后者则是物质本身与光作用的结果。
光散射能力(亦称分散力)取决于颗粒大小,当颗粒尺寸约为光波长的 1/2 (d=0.2~0.4 μm)时,光散射的效果最好。对于大多数白色颜料,颗粒尺寸尽量选择这个范围,以获得较好的遮盖力。对于 TiO2,当颗粒直径为 0.2 μm时,对光的散射力达到最大值(Mie 理论),用在香粉等化妆品中显得洁白细腻,产生很好的视觉效果。分散力也取决于波长,TiO2 颗粒越小,较短波长散射光越强,因此显示出略带蓝色调,而较大颗粒则显示偏黄的色调。近年来,已制得纳米级极细粒度的钛白粉,其分散性和耐光性都非常好,且具有很强的抗紫外线能力,广泛用于防晒制剂和遮瑕膏等。颜色浓重的无机颜料,自身已有很高的折射率,对光的吸收与反射足以产生分明的颜色,颜料颗粒需要大些,以减弱散射,一般选择 1~10 μm,如果研磨很细反而会损失颜色或产生减饱和作用。
5、颜色与有机分子结构
有机化合物(organic compound)主要指由 C、H、O、N、S、P、X 等元素组成的化合物,是生命产生的物质基础。早期,有机化合物指由动植物有机体内取得的物质。根据化学键理论知,有机化合物分子中有几种不同性质的价电子:以 σ 键相连的电子称为 σ 电子;以 π 键相连的电子称为 π 电子;氧、氮、硫、卤素等含有未成键的孤对电子,称为 n 电子(或称 p 电子)。价电子对可见光的选择吸收是分子化学中化合物呈色的重要起源,不同物质具有不同的分子结构及电子能级,因而发生电子跃迁的类型也就有很大的差异。
由于分子在发生电子跃迁时不可避免地要产生振动能级和转动能级的变动,且电子激发跃迁的过程十分迅速(约 10^-15 s),以致激发时分子来不及改变其几何构型(Franck-Condon 原理),电子在从基态能级跃迁至各可能的激发态能级时提供了一系列可能的跃迁能,于是形成的是带状吸收光谱而不是简单的线状吸收光谱。
德国化学家O N Witt(1853—1915)在 1876 年提出了发/生色团(chromophore)、助色团(auxochrome)等概念。
发色团一般指各种无色的不饱和基团,它对分子显示某种颜色起着决定性的作用,发色团越多,化合物的颜色就越深。
助色团是其本身在 200 nm 以上不具有任何重要的吸收、但带有杂原子的饱和基团,当它们被连接在发色团或饱和烃上时,却可以显著地增长发色团或饱和烃的 λ max。
发色体(chromogen)是指有色的不饱和体系或与简单的取代基结合后即转变成有色的不饱和体系。
有颜色的有机化合物整体又称为有机色素,有机色素的多样性使人类生存的物质世界绚丽多彩、美不胜收。
下图是有机色素结构示意。
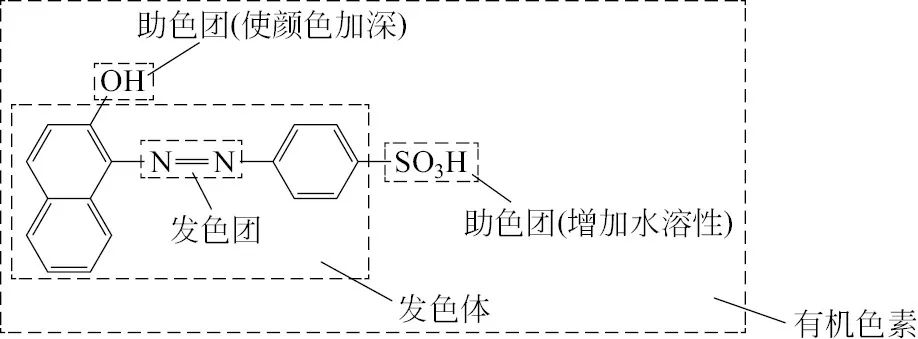
有机色素结构示意
转自——网络
